Den Einstieg finden
Mit den Moosen gemeinsam haben die Flechten, dass sie im Vergleich zu Höheren Pflanzen sehr klein sind. Ansonsten haben sie außer, dass sie z. B. wie die Moose wechselfeucht sind und uns manchmal in ähnlichen Lebensräumen ins Auge springen, wenig gemeinsam.

Ein wesentlicher Unterschied besteht darin, dass Flechten gar keine Pflanzen sind, sondern eine symbiotische Lebensgemeinschaft zwischen einem Pilz ("Mykobiont") und einem oder mehreren, den Mykobionten mit Photosyntheseprodukten versorgenden Partnern ("Photobionten"), sprich: Algen oder Cyanobakterien. Keiner der Partner wäre allein dazu imstande, die oft drastischen Standortbedingungen zu überleben, denen der zusammengesetzte Organismus Flechte bisweilen über mehr als 1000 Jahre erfolgreich trotzt, so etwa auf Steinen im Hochgebirge. Die Flechten"art" bestimmt in diesem zusammengesetzten Organismus der Pilz, nur er ist sexuell und bildet Sporen in Fruchtkörpern von unterschiedlichster Gestalt (z. B. schüssel-, strich- oder auch stecknadelförmig). Weltweit unterscheidet man rund 25.000, in Mitteleuropa etwa 2000 Arten. Die aktuelle Checkliste der in Deutschland bisher registrierten Flechtenarten können Sie hier als Excel-Tabelle runterladen.
Praktisch jedes Substrat vermögen Flechten zu besiedeln, Gesteine (auch unter Wasser), Erdboden, Bäume (Borke, Rinde, Blätter, Holz), selbstverständlich auch Moose und anthropogene Substrate wie Mauern, Grabsteine, Autos, Fensterscheiben, Gummi, Leder... Viele Flechten überziehen das Substrat flächig-krustig ("Krustenflechten"), andere sind von blättriger Gestalt und mit dem Substrat mehr oder weniger locker über spezielle Fasern verbunden ("Blattflechten"), während sich wieder andere strauchartig in die Höhe erheben oder von Zweigen oder Felsen herabhängen ("Strauch-" und "Bartflechten"). Häufig kann man auf Flechten auch parasitierende Pilze beobachten, die eine mehr oder weniger stark ausgeprägte Bindung an bestimmte Flechtenarten aufweisen. Manche Flechtenarten vermögen sehr rasch einen Lebensraum zu besiedeln, während andere dafür mindestens Jahrzehnte benötigen, wie z. B. bestimmte Charakterarten historisch alter Wälder. Ohne die entsprechende Erfahrung sieht man es einer Flechte nicht an, ob sie zu den erst- oder den letztgenannten zählt, weshalb nicht eindrücklich genug darauf hingewiesen werden kann, dass man den Kontakt zu erfahrenen Leuten oder einem wissenschaftlichen Verein suchen sollte, bevor man auf eigene Faust mit dem Sammeln und Herbarisieren von Flechten beginnt.
Welche Arten gesetzlich geschützt sind verraten die Roten Listen der Bundesländer oder die Artenschutz-Datenbank des Bundesamtes für Naturschutz. In Kürze (2022) stellen wir das Portal Flechten Deutschlands online, das, wie zuvor schon das entsprechende Moosportal (externer Link), in Zusammenarbeit mit dem Rot-Liste-Zentrum und dem Bundesamt für Naturschutz BfN aufgebaut wird. Sie können zu Naturschutzfragen auch die Rubrik Artenschutz unserer Website konsultieren. Grundsätzlich sollte man überhaupt nur dann Flechten von ihrem Standort entfernen, wenn man dies plausibel begründen kann und dafür zuvor eine eventuell erforderliche Genehmigung der Grundeigentümerin eingeholt hat. Die persönliche Einstellung, dass man mit der Entnahme sogleich die Verantwortung für den aus seinem Lebensraum entfernten Organismus übernimmt, hätte verhindern können, dass bestimmte Arten in Deutschland sogar durch Absammeln ausgerottet wurden. Generell sind Flechten aber nicht durch wissenschaftlich motiviertes Sammeln oder aus persönlichem Interesse an der Natur bedingtes Sammeln bedroht. Oft lassen sich Flechten nicht ohne Beschädigung oder Veränderung ihres Substrates entnehmen, was besonders bedeutend ist mit Blick auf Grabsteine oder gar antike Bauwerke. Diese erhalten übrigens ihre ästhetisch ansprechende Erscheinung gerade durch den Bewuchs mit zahllosen verschiedenen Flechten!

Wallis/CH; Foto: NJS
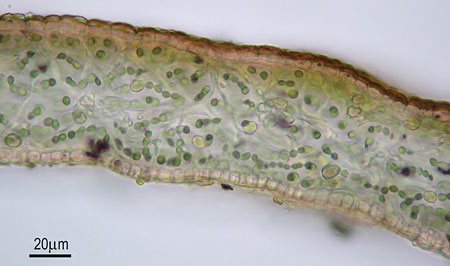
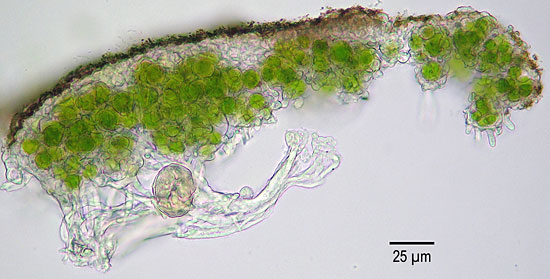
Während Moose überwiegend grün daherkommen, ist die Welt der Flechten außerordentlich bunt! Schon auf der ersten Flechtenexkursion stellt man daher fest, dass die Anzahl unserer Worte für Farben gar nicht ausreicht, um die unterschiedlichen Farbtöne von Flechten eindeutig zu beschreiben. Die in diesem Dokument bzw. auf der BLAM-Website gezeigten Flechtenbilder lassen die Gestalt- und Farbvielfalt der Flechten nur im Ansatz erahnen. Viele Flechten kann man anhand habitueller Merkmale bereits im Gelände ansprechen, während es dazu bei anderen der chemischen Analytik bedarf. Eine Aufsammlung aller auf Bäumen westeuropäischer Städte vorkommenden Flechten passt in 2 Schuhkartons. Aber: Hätten Sie gedacht, dass allein dabei schon 100 bis 200 verschiedene Arten zusammenkommen können? Selbst auf einem Schachtdeckel aus Beton über einem städtischen Abwasserkanal kann man zuweilen über 25 verschiedene Arten identifizieren! Die kleinsten einheimischen Flechten erkennt man gerade mal an z. B. submillimetergroßen "Pünktchen" auf dem Substrat, während die größten einheimischen Blatt- bzw. Bartflechten durchaus 30 cm Durchmesser bzw. Länge erreichen können, wie Lobaria amplissima bzw. Usnea filipendula. Dabei sollte man jedoch nicht glauben, dass nur die kleinsten Arten schwierig anzusprechen sind. Auf Websites findet man nicht selten offensichtlich falsch benannte, wenngleich oft sehr schöne Fotos großer Blatt- und Strauchflechten. In guten Bestimmungswerken ist das erheblich seltener der Fall.

Will man diese Winzlinge mit ihrem Namen ansprechen, benötigt man ein Minimum technischer Hilfsmittel, aktuelle Bestimmungsliteratur und die erforderlichen Kenntnisse über den Aufbau und die Lebensweise von Flechten, um die im Bestimmungsschlüssel gestellten Fragen korrekt beantworten zu können. Lehr- und Praktikumsbücher sind hier eine gute Hilfe und insbesondere für Nicht-Biologen unverzichtbar. Auch wer das Lernen am Computer vorzieht, wird sich dennoch ein oder zwei gute Bestimmungsbücher anschaffen (z. B. van Herk et al. 2017, Wirth et al. 2013 oder Smith et al. 2009) und begleitend qualifizierte Websites mit verlässlichen, aussagekräftigen Abbildungen konsultieren, wie etwa den Verspreidingsatlas Korstmossen der BLWG, ITALIC von Nimis & Martellos, Lichenology.info von Diederich et al. oder die Lichen Photo Gallery des Natural History Museum/Univ. Oslo.

Aber kein Buch und keine noch so gut aufgemachte Website können eine Exkursion mit versierten Leuten ersetzen! Das gilt für Flechten vielleicht noch mehr als für Moose. Die BLAM veranstaltet jedes Jahr ihre so genannte "Hauptexkursion", auf der man viele an Flechten (und Moosen) interessierte Menschen aus Deutschland und den Nachbarländern kennen lernen kann (tagsüber Geländeexkursion und am Abend gemeinsame Bestimmungsarbeit und Diskussion über alles Erdenkbare zu Moosen und Flechten). Auch Volkshochschulen, regionale naturkundliche Vereine oder (in NRW) die biologischen Stationen veranstalten Exkursionen oder auch Seminare über Flechten, die manchmal auch im Veranstaltungskalender der BLAM aufgeführt sind. Über das BLAM-Web, die Mailingliste der BLAM für Moos- und Flechten-Interessierte in Mitteleuropa, kann man sich z. B. mit Leuten aus der Umgebung des Wohnortes zu gemeinsamen Exkursionen verabreden. Insbesondere in grenznahen Regionen lohnt sich die Kontaktaufnahme zu Vereinen in den Nachbarländern, z. B. in den Niederlanden, der Schweiz oder Tschechien. Ebenso empfehlenswert ist ein Blick auf das Veranstaltungsprogramm einer in der Nähe befindlichen Universität. Oft gibt es an lokalen Naturkundemuseen fachkundige Personen, die gerne weiterhelfen.
Notwendige technische Hilfsmittel - was ist das Minimum?
Wenn man die Flechten eines Gebietes und die von den Arten jeweils besiedelten Substrate schon gut kennt, wird man viele Flechten auch ohne Hilfsmittel sofort ansprechen können. Aber grundsätzlich gilt: Viele Flechten sind sehr klein, und die zur korrekten Bestimmung wesentlichen Merkmale sind ohne technische Hilfsmittel (optische und/oder chemische) nicht zu identifizieren. Vieles an anderer Stelle zu Moosen Geschriebene gilt auch für die Untersuchung von Flechten.

Wichtigstes Hilfsmittel ist eine 10fach vergrößernde Lupe. Ideal sind so genannte Einschlaglupen, weil hierbei die Linse bei Nichtgebrauch in einem Gehäuse geschützt ist. Es gibt Modelle in unterschiedlichster Ausführung und Preisklasse, und "teuer" heißt nicht zwangsläufig "gut" in der Anwendung. Einfache, am häufigsten benutzte und vollauf ausreichende Modelle bestehen aus zwei plankonvexen Linsen, wobei die planen Flächen jeweils außen liegen. Preislage ab fünf Euro auf dem Flohmarkt. Einziger Nachteil ist, dass Feuchtigkeit zwischen diese Linsen gelangen kann und dann das System von innen beschlägt und somit trübe wird. Das ist zumeist dann der Fall, wenn man an besonders feuchten Stellen nach langer Regenwanderung die ganz besonders interessanten Arten erwartet... Besser und deutlich teurer sind verkittete Triplett-Lupen. Diese bestehen aus drei miteinander verklebten Linsen, ein Beschlagen von innen ist also unmöglich, und auch das nutzbare Gesichtsfeld dieser Lupen ist, bei gleichem Linsendurchmesser, meist größer. Spitzenreiter sind sogenannte Kombilupen, die aus mehreren Linsensystemen (zumeist Tripletts) bestehen, die miteinander kombiniert werden können und Vergrößerungen von z. B. 10- bis 28fach erlauben (Weinschenk-Lupe).
Ein Mitglied der BLAM, Erich Zimmermann, fertigt seit einigen Jahren mit Tripletten versehene, robuste Leuchtlupen an (nebenstehende Abbildung), die zwar sehr teuer sind, aber aufgrund der Beleuchtung mittels weißer LEDs ebenso praktisch (Hersteller-Information runterladen als PDF / download product flyer in English, PDF).

Über das Internet sind Leuchtlupen aus z. B. chinesischer Produktion von teils hervorragender optischer Qualität mit unterschiedlicher Vergrößerung und mit weißen oder UV-LEDs zu erwerben. Flechten in einem Borkenriss am Stammfuß eines Waldbaumes kann man zwar auch mit einer unbeleuchteten Lupe erkennen, doch wenn die zweite Hand dabei eine Lampe hält, merkt man doch sehr rasch, dass eine dritte Hand zum Abstützen fehlt...

3 Tropffläschchen mit Reagenzien für den C-P-K-Tüpfeltest. Diese kleinen Fläschchen enthalten Natriumhypochlorit, para-Phenylendiaminlösung oder Kalilauge. Sie erlauben eine möglichst kontrollierte Applikation kleinster Reagenztröpfchen zur Überprüfung von Farbreaktionen bestimmter Flechteninhaltsstoffe. Auf Veranstaltungen der BLAM oder Exkursionen mit Flechtenkundigen kann man erlernen, wie diese Lösungen reaktionsfreudiger Substanzen, die keinesfalls auf die Haut oder in die Augen gelangen dürfen, fachgerecht aufbewahrt bzw. mitgeführt und angewendet werden. Manche Inhaltsstoffe bewirken, dass die Flechte bei Beleuchtung mit ultraviolettem Licht etwa weiß, gelb, orange oder tiefrot fluoresziert. Bei einigen Arten reicht dazu ein sonst zur Banknotenprüfung gedachtes UV-Lämpchen aus, bessere Ergebnisse ermöglichen jedoch Laborlampen, die kurzwelligeres UV emittieren und zum Auffinden fluoreszierender Substanzen in Dünnschichtchromatogrammen verwendet werden.
Ein Stereomikroskop zum Präparieren. Ebenso wie ein Fernglas besitzt dieses Auflichtmikroskop 2 getrennte optische Tuben und ermöglicht somit räumliches Sehen ("Feldstecher für die extreme Nähe") bei Vergrößerungen zwischen typischerweise 10- und 60fach. Muss man Querschnitte von z. B. Apothecien oder Loben anfertigen, dann erledigt man das am einfachsten unter stereomikroskopischer Kontrolle. Auch kleine makroskopische Merkmale sind mit einem Stereomikroskop sehr schön zu erkennen. Der Begriff "schön" ist hier auch deshalb angebracht, weil man die Schönheit vieler Flechten insbesondere mit einem guten Stereomikroskop genießen kann! Aufgrund des doppelten optischen Aufbaus sind diese Geräte recht teuer, und für langlebige Laborausführungen mit stufenloser Vergrößerungswahl sind mindestens 1500,- Euro anzulegen.

Unverzichtbar ist ein Mikroskop. Dieses muss kein High-End-Gerät sein, aber ein Durchlichtmikroskop mit einäugigem Einblick, 40- bis 1000facher Vergrößerung (ein 100x-Ölimmersionsobjektiv ist unerlässlich für Beobachtungen an Sporen), Kondensor und Beleuchtung sind wohl das absolute Minimum. Ein Objektführer (Kreuztisch) erleichtert die Arbeit ungemein, ein höhenverstellbarer und zentrierbarer Kondensor mit Irisblende und ein Binokulartubus sind heute Standard an Mikroskopen aus dem mittleren Preissegment. Sofern man nicht durch das Mikroskop fotografieren möchte, kann man sich mit einfachen Objektiven begnügen, die nahe der optischen Achse sehr scharf abbilden (Achromat, Clinical-Plan-Achromat). Spezielle Kontrastverfahren benötigt man so gut wie nie. Die korrekte Anwendung von Färbemitteln (z. B. Lactophenolblau oder Jod-Zubereitungen, manche sind auch korrosiv) lässt man sich zunächst von erfahrenen Leuten zeigen.
Was man im Gelände zusätzlich zur Lupe dabei haben sollte: einen Spachtel zum Abheben von Flechten vom Erdboden; ein Messer mit möglichst kurzer Klinge, die sich sicher führen lässt, um Flechtenproben behutsam von Rinde oder Borke oder Gesteinen zu entnehmen; Tüpfeltestreagenzien; einen Sortierkasten, in dem man Proben unter Erhalt ihrer Struktur mitnehmen kann, um sie später im Labor zu fotografieren; Butterbrottüten ("Jausensackerl") oder aus A4-Bögen gefaltete Herbarkapseln, oder billiger: Zeitungspapier als Verpackung für die Flechtenproben.

Anspruchsvollere Methoden zur Flechtenbestimmung: Zur eindeutigen Bestimmung oder Abgrenzung von Sippen bedient man sich der Inhaltsstoffe und molekulargenetischer Merkmale der Flechten. Die dazu entwickelten Methoden sind teils sehr komplex. Hier seien beispielhaft genannt die Mikro-Rekristallisierung von Inhaltsstoffen (apparativ wenig aufwändig, setzt aber ausreichend Erfahrung voraus), die dünnschichtchromatographische (TLC bzw. HPTLC; apparativ aufwändiger als die Mikro-Rekristallisation, aber sehr aussagekräftig und in kleinen Labors mit erforderlichen Sicherheitseinrichtungen durchführbar) oder die flüssigkeitschromatografische Analyse (HPLC; apparativ aufwändig, Forschungslabors vorbehalten) von solchen Inhaltsstoffen. Fragen zu diesen Methoden können u.a. im BLAM-Web gestellt werden. Die BLAM veranstaltet ab und an auch Kurse, in denen diese Methoden vorgestellt oder angewendet werden. Sie finden die Termine in unserem Veranstaltungskalender.
Fotografische Dokumentation: Flechten sind sehr beliebte Fotoobjekte. Zuweilen sind sie sogar nicht das eigentliche Fotoobjekt, sondern der für die richtige Stimmung wesentliche Teil der Kulisse, wie etwa die Bartflechten im Nebelwald oder die üppigen Epiphyten an einem alten Parkbaum in England. Die schönsten Bilder zeigen die Arten an ihrem charakteristischen Standort bzw. auf ihrem typischen Substrat, und zur Darstellung der für die korrekte Artansprache wesentlichen Merkmale bedarf es meist der Makrofotografie, also Aufnahmen aus nächster Nähe und lebensgroßer oder sogar überlebensgroßer Abbildung auf dem Film bzw. Sensor der Kamera. Es gibt inzwischen gut entwickelte und sogar unter Geländebedingungen anwendbare Techniken zur Anfertigung sehr tiefenscharfer Makrofotos mittels Stapelbildverfahren, für die auf die Rubrik "Allgemeines zur Mooskunde" dieser Website verwiesen wird. Das unten gezeigte Makrofoto der Blattflechte Phaeophyscia endophoenicea wurde aus 450 Einzelaufnahmen mit jeweils 4 µm Abstand zu einander automatisch zusammengefügt, die Bilddimensionen betragen 3,5 x 2,4 mm mit 1,8 mm Tiefe. Die BLAM veranstaltet ab und an Mikro- und Makrofoto-Kurse, in denen man wesentliche Techniken lernen oder Tipps für den Umgang mit den bereits vorhandenen Geräten erhalten kann.