Die Pazifische Leuchterflechte (Candelaria pacifica) ist die Flechte des Jahres 2026.
Die Leuchterflechten (Gattung Candelaria) sind trotz der geringen Größe der einzelnen Individuen auffällige Bewohner der Rinde freistehender Laubbäume, da sie in der Regel in größeren Beständen auftreten und durch ihre leuchtend gelbe Farbe auffallen. Lange galt die Gewöhnliche Leuchterflechte (Candelaria concolor; Abb. 1–3) als der einzige Vertreter der Gattung in Europa, bis Westberg & Nash (2002, provisorisch) bzw. Westberg & Arup (2011, gültig) die Pazifische Leuchterflechte (Candelaria pacifica) aus Nordamerika beschrieben und auch für Europa nachwiesen.
Aussehen und Verwechlungsmöglichkeiten
Die Pazifische Leuchterflechte bildet mehr oder weniger ausgedehnte Bestände aus kleinen gelben Lagern, die teils locker dem Substrat aufliegen (Abb. 4), vorwiegend aber deutlich, fast aufrecht von ihm abstehen (Abb. 5). Sie sind in kleine Schuppen aufgelöst bzw. in Läppchen zerschlitzt, an deren Rändern und teils auch auf der Fläche meist reichlich Blastidien gebildet werden, die der Verbreitung dienen.
Die Unterseite ist unberindet (Abb. 6, 7), daher wird das spinnwebige Mark sichtbar, aus dem wenige zarte rhizinenartige Bündel entspringen. Da die Algen nicht durch eine Rinde verdeckt werden, erscheint die Unterseite zumindest feucht grünlich bis dunkelgrün, während sie in trockenem Zustand eher weißlich ist. Die Ascomata enthalten 8-sporige Asci, treten aber in Europa nur extrem selten auf.
Candelaria pacifica kann mit verschiedenen anderen gelben Rindenflechten verwechselt werden. Leicht lässt sich die Gelbe Wandflechte (Xanthoria parietina) wegen der großen, breitlappigen Lager abtrennen. Weniger einfach ist das bei der ähnlichen (siehe Name!) Leuchter-Gelbflechte (Polycauliona candelaria), die sich, wie alle Wand- und Gelbflechten-Arten, aufgrund spezifischer Inhaltsstoffe bei Betupfen mit Kalilauge (KOH) sofort tiefrot färbt. Bei den Leuchterflechten jedoch bestehen die auf der Oberrinde abgelagerten gelben Kristalle u.a. aus Pulvinsäure-Derivaten, die ihre Farbe bei Zugabe von KOH nicht verändern. Zur Unterscheidung von den ebenfalls nicht mit KOH reagierenden Dotterflechten (Candelariella) lässt sich dieses Merkmal nicht verwenden. Die rindenbewohnenden Arten dieser insgesamt recht schwierigen Gruppe bilden jedoch, wenn überhaupt, nur sehr kleine, deutlich dem Substrat anliegende Schüppchen aus. Je nach Art können diese Schüppchen mehr oder weniger deutlich ausgebildet sein oder auch gänzlich fehlen. Candelariella reflexa (Abb. 10) bildet kleine, manchmal rosettenartige Schüppchen (Areolen), in deren Zentrum Soredien gebildet werden. Die Ähnlichkeit mit Candelaria dürfte der Grund dafür sein, dass vereinzelt Exemplare von C. pacifica als "Candelariella reflexa" in Herbarien abgelegt wurden (Dolnik 2013).
Am ehesten zu verwechseln ist die Art mit Candelaria concolor und viele ältere unter diesem Namen abgelegte Herbarbelege gehören wohl zu C. pacifica. Da C. pacifica bei uns nur steril auftritt, kann die Anzahl der Sporen pro Ascus als Merkmal nicht herangezogen werden (bei C. concolor sind sie vielsporig). Als bereits im Gelände brauchbares Merkmal erweist sich die spinnwebige, feucht grüne, unberindete Unterseite mit sehr zarten, rhizinenartigen Strukturen. Bei C. concolor ist die berindete Unterseite glänzend weiß und aus ihr entspringen kräftige Rhizinen. Habituell sind die Lager von Candelaria concolor deutlich kräftiger, die Läppchen sind ziemlich regelmäßig mehrfach zerteilt und eher dem Substrat anliegend, während sie bei C. pacifica kleiner, kaum oder unregelmäßig zerteilt, eher aufrecht und oft sehr reichlich mit Blastidien besetzt sind. Im Zweifelsfall bringt die mikroskopische Betrachtung eines Schnitts Klarheit über das Vorhandensein oder Fehlen einer Unterrinde (Abb.8 und Abb.9). Eine Zusammenstellung der unterscheidenden Merkmale gibt Stapper (2012).
Die verwandtschaftlichen Beziehungen innerhalb der Candelariales sind trotz molekularer Untersuchungen einiger Arten (z. B. Westberg & Arup 2011, Kondratyuk et al. 2020, Ramos et al. 2025) nicht abschließend geklärt, so dass sich hier in Zukunft sicher noch nomenklatorische Änderungen ergeben werden. Die Untersuchungen legen aber nahe, dass C. pacifica nicht nahe mit C. concolor verwandt ist sondern eher in die Verwandtschaft einer Gruppe um Candelariella medians und C. aurella zu stellen ist.
Ökologie
Candelaria pacifica tritt zusammen mit C. concolor auf der subneutralen bis mäßig sauren, meist staubimprägnierten, eutrophierten Rinde von freistehenden Laubbäumen und -sträuchern auf, selten auch an Nadelbäumen und Holz oder ganz selten auf Gestein.
Die Art dringt weit bis in die Städte vor. Im Nordwestdeutschen Tiefland tritt sie besonders an alten Linden (aber auch an anderen Laubbäumen wie Eiche, Rosskastanie oder Ahorn) im Siedlungsbereich auf (Dolnik 2013, M. Schultz mdl.), während Cezanne & Eichler (2015) sie im Süden Deutschlands vor allem von Ahorn und Eiche, aber auch an Pappel, Walnuss, Kirsche, Weide, Linde, Esche, Apfelbaum, Hainbuche, Ulme, Holunder, Robinie, Erle, Götter- und Maulbeerbaum sowie an Pfaffenhütchen fanden.
Die ökologischen Ansprüche von Candelaria pacifica scheinen denen von C. concolor ziemlich ähnlich zu sein. Auch wenn beide Arten in Europa bis weit nach Osten hin vorkommen, bevorzugen sie doch Bereiche mit ozeanischem Klima.
Verbreitung und Gefährdung
Unsere Flechte des Jahres 2026 wurde erst vor wenigen Jahren von C. concolor abgetrennt, weshalb über ihre Verbreitung nur ungenügende Kenntnisse vorliegen. Beschrieben wurde sie von der Westküste Nordamerikas; Westberg & Arup (2011) berichten darüber hinaus von Vorkommen aus Südamerika, Skandinavien, den Niederlanden und der Türkei. In der Folge wurde sie aus zahlreichen anderen europäischen Ländern gemeldet. In Nordeuropa scheint sie häufiger zu sein als ihre Schwesterart. Für den deutschsprachigen Raum berichtete Bomble (2012) erstmals über Vorkommen von C. pacifica im Raum Aachen, was andere dazu motivierte, in ihren Herbarien nach unter anderem Namen abgelegten C. pacifica-Belegen zu suchen. Für Düsseldorf fand sich ein Beleg von 2009 (Stapper 2012), aber für Gainberg in Oberösterreich, sogar von 1989 (Neuwirth 2014). Westberg & Clerc (2012) melden C. pacifica aus der Schweiz, Dolnik (2013) aus Schleswig-Holstein, Cezanne & Eichler (2015) aus Hessen, Wirth (2016) aus Baden-Württemberg, Hessen und dem westlichen Teil Bayerns (Unterfranken und Schwaben), Schiefelbein et al. (2018) aus Mecklenburg-Vorpommern, Meinunger (2019) aus Thüringen, Nordostbayern und der hessischen Rhön.
Candelaria pacifica wurde zuerst im Westen von Deutschland und danach zunehmend häufig auch in den anderen Landesteilen beobachtet, was zu der Annahme führte, die Art breite sich von Westen nach Osten aus. Allerdings wurden bei einer gründlichen Nachbestimmung des gesamten norddeutschen Materials von Candelaria concolor im Herbarium der Universität Hamburg auch Belege von C. pacifica vom Ende des 19. Jahrhunderts entdeckt (Paul 2021, unpubl. Projektstudie im Herbarium Hamburgense). Anlässlich einer landesweiten Epiphytenkartierung von Nordrhein-Westfalen (Franzen et al. 2002) wurde Candelaria concolor (damals noch einschließlich C. pacifica) zwischen 2000 und 2002 nur an drei von 1815 Stationsbäumen in diesem Bundesland registriert, sie war also zu dieser Zeit noch eine seltene Art. Dann setzte eine ungeheuer rasche Ausbreitung von C. concolor ein. Im Rahmen eines Langzeitmonitorings in Düsseldorf mit jährlichen Wiederholungen wurde sie 2003 bereits an 12 % und dann kontinuierlich häufiger, inzwischen an 80 bis 90 % aller Stationsbäume registriert (Stapper 2025). C. pacifica wurde erst 2012 getrennt erfasst, auch sie wurde seitdem von Jahr zu Jahr häufiger und inzwischen an rund 20 % der Stationsbäume nachgewiesen. Die Trennung der beiden Arten wird dadurch erschwert, dass sie an den Bäumen manchmal Mischrasen bilden.
Da Candelaria pacifica offenbar in Ausbreitung begriffen ist, erscheint sie auf den Roten Listen nicht als gefährdet, sofern sie überhaupt schon aufgeführt wird. In der kommenden Roten Liste der Flechten Deutschlands (Printzen et al. in Vorb.) wird der Art eine Zunahme in den letzten Jahrzehnten attestiert. Nachdem der Wert von freistehenden Laubbäumen sowohl in der offenen Landschaft wie auch in der Stadt endlich breit anerkannt wird und die Luftbelastung mit Schwefelverbindungen weitgehend der Vergangenheit angehört, liegen für die an eutrophierter Rinde wachsende Art keine erkennbaren Gefährdungsursachen vor.
Biologie
Candelariella pacifica verbreitet sich sowohl generativ (sexuell) durch Sporen, die in den Schläuchen (Asci) der Fruchtkörper (Apothecien) gebildet werden, wie auch vegetativ durch Blastidien, kleinen Thallusabschnürungen, die an den Spitzen, später auch an den Rändern und auf der Fläche der Thalli entstehen. In Europa wurde die Bildung von Apothecien bisher nur einmal in der Türkei beobachtet, während sie in Nordamerika gelegentlich vorkommt.
Wie alle Flechten lebt die Art mit einem photosynthetisch aktiven Symbiosepartner zusammen, in diesem Fall mit chlorococcoiden Grünalgen.
Parasiten
Wohl auch weil die Art erst vor kurzem beschrieben wurde, sind auf ihr noch keine für sie spezifischen Parasiten bekannt geworden. Zu erwarten sind aber solche, die auf verschiedenen anderen Arten der Familie vorkommen, wie Athelia arachnoidea (Berk.) Jülich, Acarospora subfuscescens (Nyl.) H. Magn., Ascochyta candelariellicola, Ciliomyces oropensis, Epithamnolia xanthoriae, Erythricium aurantiacum, Illosporiopsis christiansenii, Intralichen lichenicola, Sarcopyrenia gibba var. geisleri, Tremella candelariellae oder Trimmatostroma vandenboomii.
Abbildung 11 zeigt einen Rasen, der von einem Pilz, wahrscheinlich Athelia arachnoidea, angegriffen wird. Da der Pilz von den Algen lebt, wird die Flechte bleich, bevor sie gänzlich abstirbt.
Links im Web
https://en.wikipedia.org/wiki/Candelaria_pacifica (Wikipedia-Artikel englisch)
https://italic.units.it/index.php?procedure=taxonpage&num=499 (Beschreibung, Bilder)
https://www.gbif.org/occurrence/gallery?taxon_key=5260442 (Bildersammlung, noch keine Verbreitungskarte).
https://britishlichensociety.org.uk/resources/species-accounts/candelaria-pacifica (Beschreibung, Bilder)
https://fungi.myspecies.info/all-fungi/candelaria-pacifica (Beschreibung, Bilder)
https://www.afl-lichenologie.fr/Photos_AFL/Photos_AFL_C/Textes_C3/Candelaria_pacifica.htm (Beschreibung, Bilder)
https://www.waysofenlichenment.net/lichens/Candelaria%20pacifica (Bilder)
Literatur
Bomble, W. 2012. Candelaria pacifica und Xanthomendoza borealis im Aachener Raum – neu für Deutschland. – Veröffentlichungen des Bochumer Botanischen Vereins 4(1): 1–8. URL: https://www.botanik-bochum.de/publ/OVBBV4_1_Bomble_Candelaria_pacifica_Xanthomendoza_borealis.pdf
Cezanne, R. & Eichler, M. 2015. Verbreitungsatlas der Flechten von Darmstadt. – Botanik und Naturschutz in Hessen, Beiheft 12: 1–239. URL: https://www.zobodat.at/pdf/Botanik-Naturschutz-Hessen_BH_12_0001-0239.pdf
Dolnik, C. 2013. Candelaria pacifica und andere bemerkenswerte Flechten aus Schleswig-Holstein. – Kieler Notizen zur Pflanzenkunde 39: 11–18. URL: https://www.zobodat.at/pdf/Kieler-Notizen-zur-Pflanzenkunde_39_0011-0018.pdf
Franzen, I., Stapper, N.J. & Frahm, J.-P. 2002: Ermittlung der lufthygienischen Situation Nordrhein-Westfalens mit epiphytischen Flechten und Moosen als Bioindikatoren. Gutachten im Auftrag des Ministeriums für Umwelt und Naturschutz, Landwirtschaft und Verbraucherschutz Nordrhein-Westfalen – MUNLV. 41 S.
Kondratyuk,S.Y., Lőkös, L., Jeong, M.-H., Oh, S.-O., Kondratiuk, A.S. & Hur, J.-S. 2020. Contributions to molecular phylogeny of lichen-forming fungi, 1. The family Candelariaceae. – Acta Botanica Hungarica 62(3–4): 293–307.
Meinunger, L. 2019. Florenatlas der Flechten des Thüringer Waldes, der Rhön und angrenzender Gebiete. – Haussknechtia Beiheft 20: 1–1403.
Neuwirth, G. 2014. Revision of the genus Candelaria (Ascomycota, Candelariales) in Upper Austria. – Stapfia 110: 39–46. URL: https://www.zobodat.at/pdf/STAPFIA_0101_0039-0046.pdf
Printzen, C. et al. (in Vorb.) Rote Liste der Flechten, flechtenbewohnenden und flechtenähnlichen Pilze Deutschlands.
Ramos, D., Hollinger, J. & Bungartz, F. 2025. Two new species of Placomaronea (Candelariaceae: lichenized Ascomycota) in Peru, with a revision of secondary chemistry and cortical anatomy of Placomaronea, Candelina and Candelariella. – Lichenologist 57: 61–81.
Schiefelbein, U., Brackel, W. v., Cezanne, R., Eichler, M., Krzewicka, B., Neumann, P., Schultz, M. & Dolnik, C. 2028. Additional interesting records of lichenized and lichenicolous fungi from Northern Germany. – Herzogia 31: 114–132. URL: https://www.researchgate.net/publication/326801090_Additional_Interesting_Records_of_Lichenized_and_Lichenicolous_Fungi_from_Northern_Germany
Stapper, N. 2012. Illustrierte Bestimmungshilfe zur Unterscheidung von Candelaria concolor und Candelaria pacifica. – Archive for Lichenology 7: 1–12. URL: https://fschumm.de/Archive/Vol07_Stapper_Candelaria_pacifica_concolor_03Mai2012.pdf
Stapper, N.J. 2025: Flechten. - In: Schmitz, U., Stapper, N., Stevens, M., Wirooks, L., Diestelhorst, O. & Busch, J. (2025): Klimafolgenmonitoring Landeshauptstadt Düsseldorf 2024 – Untersuchungen der Auswirkungen des Klimawandels auf ausgewählte Gruppen der Tier- und Pflanzenwelt. – Gutachten der Biologischen Station Haus Bürgel im Auftrag des Umweltamtes der Landeshauptstadt Düsseldorf in Kooperation mit der Unteren Naturschutzbehörde, Garten-, Friedhofs- und Forstamt. 272 S.
Westberg, M. & Arup, U. 2011. Candelaria pacifica sp. nova (Ascomycota, Candelariales) and the identity of Candelaria vulgaris. – Bibliotheca Lichenologica 106: 353–364.
Westberg, M. & Clerc, P. 2012. Five species of Candelaria and Candelariella (Ascomycota, Candelariales) new to Switzerland. – MycoKeys 3: 1–12. URL: https://mycokeys.pensoft.net/article/1185/
Westberg, M. & Nash III, T. H. 2002. Candelaria. – In: Nash, T. H. III., Ryan, B. D., Gries, C. & Bungartz, F. (eds.) 2002. Lichen Flora of the Geater Sonoran Desert Region Vol. I. – Arizona State University, Tempe: 116–118.
Wirth, V. 2016. Bemerkenswerte Funde von Flechten in Süddeutschland und Umgebung. – Carolinea 74: 11–22. URL: https://regionalia.blb-karlsruhe.de/frontdoor/deliver/index/docId/19641/file/BLB_Wirth_Flechten_Sueddeutschland.pdf
Wirth, V., Hauck, M. & Schultz, M. 2013. Die Flechten Deutschlands. – E. Ulmer, Stuttgart.
Bilder von Candelaria pacifica und ähnlichen Arten
Durch Anklicken der Bilder öffnet sich jeweils eine größere bzw. vollständige Bild-Version
Abb.1: Lange galt Candelaria concolor als einziger Vertreter der Gattung Candelaria (Foto: Norbert Stapper).
Abb.2: Candelaria concolor mit Apothecium (Foto: Norbert Stapper).
Abb.3: Unterseite von Candelaria concolor (Foto: Norbert Stapper).
Abb.4: Die gelben, lockeren Lager von Candelaria pacifica (Foto: Norbert Stapper).
Abb.5: Typische Lager von Candelaria pacifica, die vorwiegend deutlich, fast aufrecht vom Substrat abstehen (Foto: Norbert Stapper).

Abb.6: Die unberindete Unterseite von Candelaria pacifica, Düsseldorf (Foto: Norbert Stapper).

Abb.7: Die unberindete Unterseite von Candelaria pacifica, Düsseldorf (Foto: Norbert Stapper).

Abb.8: Candelaria concolor im Querschnitt mit Unterrinde (Foto: Norbert Stapper).
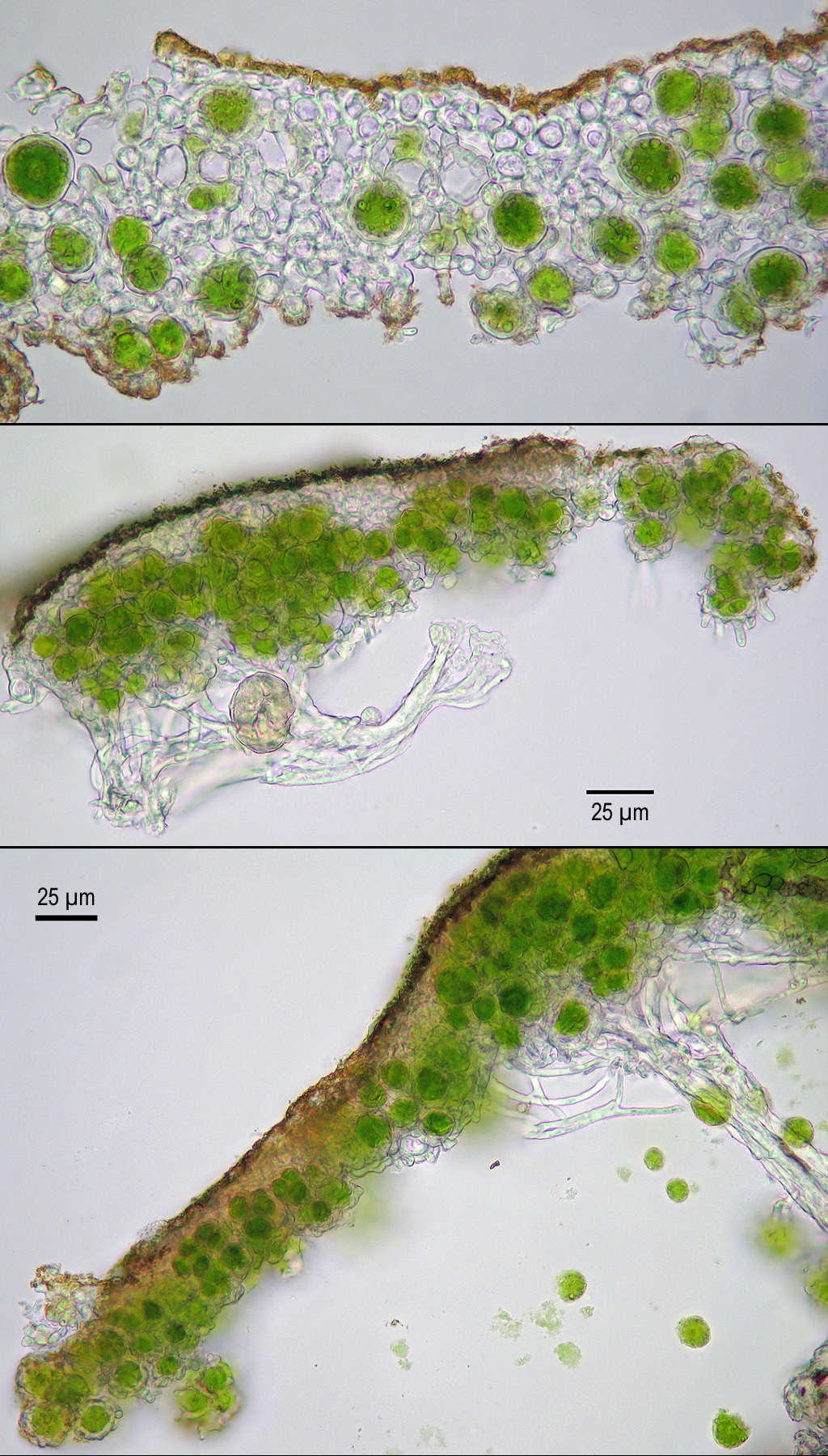
Abb.9: Candelaria pacifica im Querschnitt ohne Unterrinde (Foto: Norbert Stapper).

Abb.10: Candelariella reflexa bildet kleine, manchmal rosettenartige Schüppchen (Areolen), in deren Zentrum Soredien gebildet werden (Foto: Norbert Stapper).

Abb.11: Rasen von Candelaria pacifica, der von einem Pilz, wahrscheinlich Athelia arachnoidea, angegriffen wird. Da der Pilz von den Algen lebt, wird die Flechte bleich, bevor sie gänzlich abstirbt (Foto: Norbert Stapper).

Der Flechte des Jahres 2026 ähnlich: Candelaria concolor (Foto: Matthias Schultz).

Candelaria pacifica im Habitus (Foto: Matthias Schultz).






























